便秘はCKD発症と関連するか?
Constipation and incident CKD.
J Am Soc Nephrol. 2017;28:1248-58.
https://www.ncbi.nlm.nih.gov/pubmed/?term=28122944
1.背景
便秘症はプライマリケア領域で一般的な症状だが、一方で心血管イベント発生のリスクであり、腸内細菌関連の炎症が原因とされている。便秘が炎症と関連するのであれば、同じ機序でCKD発症のリスク要因となる可能性があるものの、実際に検討した研究はない。
2.論文の定式化(PICO/PECO)
P:18歳以上の非CKD患者(eGFR≧60)
E:便秘症がある
C:便秘症がない
O:①CKD発症 ②ESKD発症 ③eGFR低下※
※①eGFR<60かつベースラインから25%低下
※②透析導入 or 先行的腎移植
※③5段階評価 (<-10, ~-5, ~-1, ~0, ≧0)
3.研究デザイン & 統計解析
後向きコホート研究, Cox回帰(①②), Logistic回帰(③)
年齢, 性, 人種, 併存症, eGFR, 収入で層別解析
傾向スコア(PS) マッチングによる解析
4.結果の吟味
米国退役軍人3504732名が対象(うち7%が便秘症)。患者平均 60歳, 男93%, 黒人15%, BMI29, DM25%, CHD11%, eGFR84, RASI内服22%。
中央値7年間で CKD発症17.2/千人年, ESKD発症0.39/千人年, eGFR低下<-10: 3.7%, -10~-5: 5.9%, -5~-1: 27.9%。便秘症があるとアウトカムに有意な関連あり。
①CKD発症: HR1.13(1.11-1.14)
②ESKD発症: HR1.09(1.01-1.18)
③eGFR低下: OR (<-10):1.17(1.14-1.20), (~-5):1.07(1.04-1.09), (~-1):1.01(1.00-1.03)
層別解析、PSマッチングでも同様の結果

研究結果は妥当なものか?(内的妥当性)
①便秘症は正しく評価されているか?
60日以上離れて2回の便秘症(ICD-9)の診断がついている場合、または、30日以上の下剤処方が60日以上(365日以内)に2回以上されている場合を便秘症の定義とし、下剤の処方数に基づいて便秘症の重症度を評価している。これは便秘症の診断を過小評価あるいは過大評価している可能性があり、結果に影響を与えうる。
②便秘症がある群とない群で背景は等しいか?
便秘症がある群の方が高齢で、黒人, (HIV/AIDSを除く)併存症, 低収入, 未婚の割合が多い。これらは交絡要因として予後に影響しうるが、統計解析上は調整されている。
③便秘症と腎予後の関連性は妥当か?
多変量解析で便秘症と腎予後の有意な関連が示されているが、効果量(点推定値)は大きくなく、症例数が多く統計学的パワーが大きいために有意差を検出できている。また、観察研究であり調整が不十分な可能性は残るが(residual confounding)、一方でPSマッチングによる感度分析で同様の結果が得られている。
自分の患者にあてはまるか?(外的妥当性)
米国退役軍人が対象で人種, 基礎疾患, 社会背景が日本人と大きく異なり、男性がほとんどであることから、日本人あるいは女性に対して同様な結果が得られるかわからない。また非CKD患者(eGFR≧60)を対象としており、CKD患者の便秘と腎予後の関連については言及できない。
コメント
プライマリケア領域でよく見られる便秘症が、CKD発症リスクである可能性を示した点でインパクトのある研究です。一方で、病態として便秘がなぜ腎予後と関連するのか、そのメカニズムについて慎重に検討する必要があります。ひょっとしたら、他の予後悪化因子の結果として便秘を見ている、あるいは、治療薬である下剤がむしろ腎予後を悪化させている可能性も否定できません。少なくとも、便秘症を予防・治療することで腎予後が改善するかどうかについては、本研究の結果から言及できません。
参考文献
①腸内細菌と心血管病に関する総説。②日本人が対象。下剤使用は心血管死のリスクだが、便秘(排便が2,3日毎や4日毎以上)はリスクではなかった。③米国女性が対象。排便回数が多いこと(1日2回以上)は死亡リスクであった。④CKDと腸内細菌に関する総説。⑤CKD患者に対するprobiotics(pre-, synbioticsを含む)の効果を検証したSystematic Review。腎機能低下, 心血管病に対し有意な効果は認められなかった。
① The contributory role of gut microbiota in cardiovascular disease. J Clin Invest. 2014;124:4204.
② Bowel Movement Frequency, Laxative Use, and Mortality From Coronary Heart Disease and Stroke Among Japanese Men and Women: The Japan Collaborative Cohort (JACC) Study. J Epidemiol. 2016;26:242.
③ Associations of Bowel Movement Frequency with Risk of Cardiovascular Disease and Mortality among US Women. Sci Rep. 2016;6:33005.
④ Role of the Gut Microbiome in Uremia: A Potential Therapeutic Target. Am J Kidney Dis. 2016;67:483.
⑤ Biotic Supplements for Renal Patients: A Systematic Review and Meta-Analysis. Nutrients. 2018;10. pii: E1224.
血尿が寛解するとIgA腎症の予後は改善するか?
Remission of Hematuria Improves Renal Survival in IgA Nephropathy.
JASN 2017; 28: 3089-99.
https://www.ncbi.nlm.nih.gov/pubmed/?term=28592423
1.背景
IgA腎症が末期腎不全(ESKD)に進展する予測因子として高血圧, 診断時の腎機能, 経過中の尿蛋白が知られている。しかし血尿がESRD進展と関連するか検証した報告は少ない。
2.論文の定式化(PICO/PECO)
P:IgA腎症患者
E:血尿の持続 (H+) ※
C:血尿の寛解 (H-) ※
O:①ESRD ②eGFR50%低下 ③eGFR低下速度
※観察期間平均URBC (TA-URBC)
H+: >5/hpf, H-: ≦5/hpf
3.研究デザイン & 統計解析
過去起点コホート研究/Cox回帰
尿蛋白(UP)※, 免疫抑制治療(IS)の有無で層別化
※UP+: >0.75g/日
4.結果の吟味
IgA腎症患者112名(スペイン単施設)が対象。DM, 二次性IgAN, HSPNの患者は除外。
男性7割, 白人96%, 平均42歳, ベースラインのsCr1.8, eGFR58, UP1.4g/日, URBC50/hpf
(ベースラインで血尿陰性の患者はなし)
治療: RASI 84%, IS 39%, ステロイド投与期間 7±7ヵ月
平均観察期間14年で17%がESRDへ進展
outcomeごとの比較 (H+ vs H-)
①ESRD:11% vs 30% (P =0.01)
②eGFR50%低下: 15% vs 37% (P =0.01),
③eGFR年次低下速度: -1.5 vs -3.3 (P =0.06)
H+はESRDのリスク, 調整HR2.8 (1.1-7.3)
血尿陰性化前後のeGFR低下速度: 前-6.5±14.8 vs 後-0.2±2.6 (P=0.001)
層別解析ではISの有無で予後に差なし
H+かつUP+の群は予後不良
H+かつUP+の群ではISの有無で予後に差なし




研究結果は妥当なものか?(内的妥当性)
①暴露として血尿寛解を正しく捉えているか
本研究が着目している“血尿”はベースライン値ではなく、観察期間平均(time average, 平均14年間で6ヶ月毎検査の平均)の値である。これによって血尿寛解を簡潔かつ巧みに評価している一方、血尿の推移のvariationを捉えられない(平均値が同じでも、観察期間の前半・後半のどちらで血尿の程度が強かったか区別できず、臨床経過が全く異なる可能性がある)。
②H+とH-の患者間で背景は等しいか?
年齢, 性, 人種, 腎機能, 内服薬は群間で有意差なし。H+で病理Mスコアが有意に高く、尿蛋白と病理Sスコアの差はMarginal。MEST以外の病理所見や喫煙, 肥満は記載なく群間差は不明。
③血尿寛解と腎予後の関連性は妥当か?
多変量解析にて血尿寛解と腎予後の有意な関連が示されているが、本研究の症例数は多くなく調整因子の数も限られており、調整が不十分な可能性(residual confounding)は否定できない。
約4割の患者がIS(平均7.3ヵ月)を受けているが、治療適応が不明瞭で交絡(indication bias)の可能性がある。ISと腎予後に有意な関連はなく結果の解釈に慎重を要する。
UP, ISの有無で層別した解析は統計学的に検定されておらず十分な評価とは言えない(症例数が多くなく解析上やむを得ない)。
自分の患者にあてはまるか?(外的妥当性)
スペインのIgA腎症患者が対象であり、人種や医療体制(腎生検や治療の適応, 治療内容)が日本と異なり、同様の結果が得られるかわからない(日本では治療として扁摘摘出やステロイドパルスを行うが、一方でMMF, AZA, CYC(エンドキサン)は通常使用しない)。また、本研究の対象は比較的若年で中等度以上の腎機能低下と蛋白尿を呈する患者であり、蛋白尿が軽微な患者や高齢者にあてはまるかわからない。
コメント
IgA腎症の特徴である血尿の寛解が、尿蛋白とは独立して腎予後と関連し、IgA腎症の治療指標となる可能性を示した点で、インパクトのある研究です。血尿が改善するとなぜ腎予後が改善するのか、その病態を改めて考える上でも示唆に富んでいます。一方で本研究は観察研究であり、治療選択に伴うバイアスを考慮すると、多変量解析の結果であっても解釈には慎重を要します(“血尿は予後と関連しない”とする先行研究の結果との違いをどのように解釈し臨床に応用するのか、臨床力が問われます)。少なくともIgA腎症に対する薬剤治療の効果について本論文で論じることは控えた方がよさそうです。
参考文献
①は本論文のEditorial。IgA腎症の血尿に対する海外の認識を知る上で参考となる。②は中国のコホート。血尿と腎予後の関連を示唆。③④日本のコホート。蛋白尿の有無でそれぞれ解析しているが、ともに血尿と腎予後の間に有意な関連なし。
① Persistent Microscopic Hematuria as a Risk Factor for Progression of IgA Nephropathy: New Floodlight on a Nearly Forgotten Biomarker. J Am Soc Nephrol. 2017;28:2831.
② Long-term renal survival and related risk factors in patients with IgA nephropathy: results from a cohort of 1155 cases in a Chinese adult population. Nephrol Dial Transplant. 2012;27:1479.
③ Effect of hematuria on the outcome of IgA nephropathy with mild proteinuria. Clin Exp Nephrol. 2015;19:815.
④ Effect of hematuria on the outcome of immunoglobulin A nephropathy with proteinuria. J Nephropathol. 2016;5:72.
カフェイン摂取はCKD患者の生命予後と関連するか?
Caffeine consumption and mortality in chronic kidney disease: a nationally representative analysis.
Nephrol Dial Transplant. 2018 [Epub ahead of print]
https://www.ncbi.nlm.nih.gov/pubmed/?term=30215779
1.背景
一般人口ではコーヒー摂取と死亡リスクの間に負の関連があることが報告されている。しかしCKD患者におけるカフェイン摂取と死亡リスクの関連については不明である。
2.論文の定式化(PICO/PECO)
P:18歳以上のCKD患者 ※1
E:カフェイン摂取が多い ※2
C:カフェイン摂取が少ない ※2
O:(主)全死亡
(副)心血管死, 腫瘍死
※1: eGFR15-60 or ACR>30mg/gCr, 透析患者は除外
※2: 四分位による分類
3.研究デザイン & 統計解析
後向きコホート研究, Cox回帰モデル
CKD stage(G)とアルブミン尿(ACR)で層別解析(交互作用を検討)
カフェイン源であるコーヒー, 紅茶, 清涼飲料の摂取と予後について追加解析
4.結果の吟味
4863人の米国CKD患者が対象(NHANES研究)
患者平均 60歳, BMI29, DM23%, 心筋虚血既往15%, eGFR65, ACR40mg/gCr
カフェイン摂取(中央値/日) Q1: 3mg, Q2: 65, Q3: 148, Q4: 316
※コーヒー100mlのカフェイン含有量の目安は60mg
中央値 60ヶ月間の観察で1283名(26%)が死亡。
カフェイン摂取量と総死亡は負の関連。
HR(Q1:対照) Q2: 0.74(0.60-0.91), Q3:0.75(0.61-0.92), Q4:0.75(0.59-0.97)
カフェイン摂取量と心血管死, 腫瘍死では有意な関連なし。
層別解析でCKD stage, ACRに交互作用なし。
追加解析でコーヒー, 紅茶と総死亡に有意な関連なし。清涼飲料と総死亡に有意な関連あり。


研究結果は妥当なものか?(内的妥当性)
①カフェイン摂取量は正しく評価されているか?
実測ではなく1日分の食事アンケート調査に基づいている。カフェイン摂取量はベースラインのみで評価され、その後の摂取量の変動は考慮されていない。また、飲料以外のカフェイン摂取量は評価されていない。
②カフェイン摂取が多い群と少ない群で背景は等しいか?
カフェイン摂取が多い群で、男性, 白人, 高い教育レベル, 高収入, 喫煙, アルコール摂取が多く、脳梗塞が少なく、食事に関してはカリウム摂取が多く、炭水化物・食物繊維の摂取が少なく、不飽和脂肪酸/飽和脂肪酸の比が低かった。これらは交絡要因として予後に影響しうるが、統計解析上は調整されている。
③カフェイン摂取と総死亡の関連性は妥当か?
多変量解析を行っているが、栄養状態や身体活動性など他の交絡の調整が不十分な可能性は残る(residual confounding)。ただしカフェイン摂取が多い群に喫煙者が多く、必ずしも効果を過大評価するバイアスだけではない。
コーヒーによるカフェイン摂取と総死亡の関連は有意でなかったが、主解析と比しイベント数が少なく統計学的パワー不足の可能性はある。一方、清涼飲料によるカフェイン摂取と総死亡の関連は有意だが、因果関係が逆転しているかもしれない(元気な人がカフェイン入り清涼飲料を飲んでいた可能性を否定できない)。
自分の患者にあてはまるか?(外的妥当性)
本研究では米国のCKD患者が対象で、人種やBMI等の患者背景や生活環境が日本と異なり、同様の結果となるかわからない。
コメント
本研究の結果からは、CKD患者のカフェイン摂取が、生命予後の観点から悪いことではなさそうです。しかし本研究は観察研究であり、カフェインが生命予後を改善する機序も明らかでないことから、「CKD患者は生命予後の点からカフェインを摂取した方がよい」と結論づけることはできません。また、コーヒーによるカフェイン摂取とCKD患者の生命予後との関連は有意ではなく、本研究からCKD患者のコーヒー摂取の是非について言及することは控えた方がよいでしょう。
参考文献
①は一般人口を対象にカフェイン摂取が良好な生命予後と関連することを示した米国の観察研究(NHANES)。②③は一般人口を対象にコーヒー摂取が良好な生命予後と関連することを示した米国と日本の観察研究。④は一般人口を対象にコーヒー摂取が多いとCKD発症リスクが低いことを示した米国の観察研究(ARIC)。過去ログ参照。
https://nephrologist.hatenablog.com/entry/2018/09/19/062315
①Association Between Caffeine Intake and All-Cause and Cause-Specific Mortality: A Population-Based Prospective Cohort Study. Mayo Clin Proc. 2017;92:1190.
②Association of coffee drinking with total and cause-specific mortality. N Engl J Med. 2012;366:1891.
③Association of coffee intake with total and cause-specific mortality in a Japanese population: the Japan Public Health Center-based Prospective Study. Am J Clin Nutr. 2015;101:1029.
④Coffee Consumption and Incident Kidney Disease: Results From the Atherosclerosis Risk in Communities (ARIC) Study. Am J Kidney Dis. 2018;72:214.
胎児期の発育は、成人のCKD発症と関連するか?
Prenatal Growth and CKD in Older Adults: Longitudinal Findings From the Helsinki Birth Cohort Study, 1924-1944.
Am J Kidney Dis. 2018;71:20-26.
https://www.ncbi.nlm.nih.gov/pubmed/?term=28838764
1.背景
胎児期・生後初期の環境が高血圧, 糖尿病, 冠動脈疾患といった成人疾患の発症に関与しているという概念(Developmental Origins of Health and Disease/DOHaD)が近年注目されている。DOHaDはCKDの発症・進行にも関連すると考えられており、低出生体重とCKD発症の関連が報告されているが、出生から高齢まで観察されている研究は少ない。
2.論文の定式化(PICO/PECO)
P:出生から死亡または86歳まで追跡できた人
E:胎内発育※が不良, または早期産
C:胎内発育※が良好, または正期産
O:CKD発症※※
※出生時体重, 体格指数, 胎盤重量, 出生時身長
※※CKDでの死亡または入院から推定
3.研究デザイン & 統計解析
前向きコホート研究(観察研究)
生存時間分析(Cox比例ハザードモデル)
4.結果の吟味
ヘルシンキ大学病院で出生した20431名が対象(出生: 1924-33年7086名, 1934-44年13345名)。
CKD発症は375名(1.8%)。そのうち男性226名(2.1%), 女性149名(1.5%)でCKD診断時の年齢はそれぞれ64.3歳, 64.9歳。
出生時体重は男女ともCKD発症と有意に関連。出生時体重1SDあたりHR:0.82(0.74-0.91)。
体格指数, 胎盤重量, 出生時身長は、男性のみ、CKD発症と有意に関連。
早期産(34週未満)は、女性のみ、CKD発症と有意に関連。

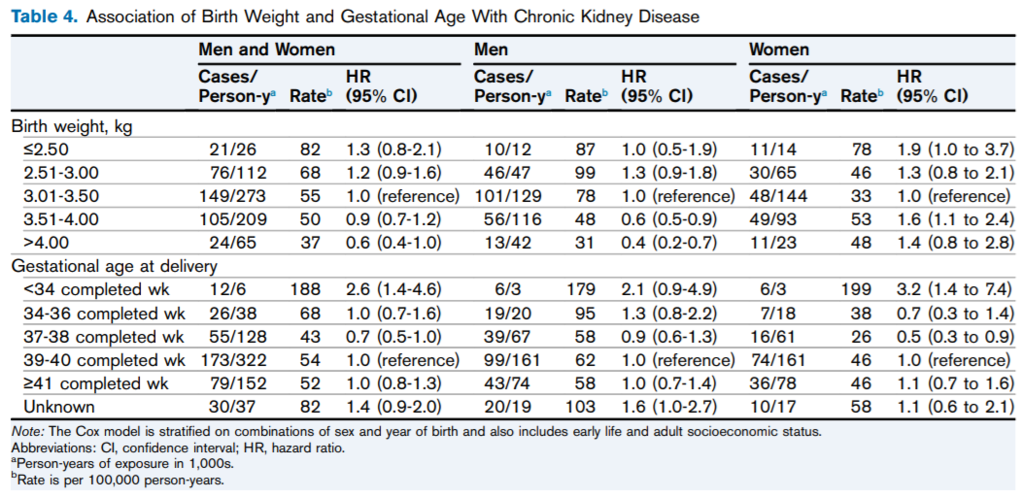
研究結果は妥当なものか?(内的妥当性)
①群間の背景は同等か?
性別の患者背景は記載されているが、本研究で着目している胎内発育や在胎週数による背景の違いは記されていない。予後に影響しうる要因が群間で異なれば交絡として予後に影響しうるが、本研究では群間差はわからない。
②胎児発育と成人CKD発症の関連は妥当か?
解析では性、出生年、社会経済的背景(父親の職業、成人後の職業)が考慮されているが、その他の交絡要因に対する調整が不十分な可能性は残る(residual confounding)。
本研究は、CKDをInternational Classification of Disease(ICD)で定義し、GFRや尿蛋白で評価していない。またCKD発症を「CKDでの死亡あるいは入院」としてデータから抽出しており、外来での診断は含まれていない。以上よりCKD発症を過小評価している可能性があるが、それでも有意差は検出されている。
自分の患者にあてはまるか?(外的妥当性)
本研究はヘルシンキ(フィンランド)の一般人口が対象で、人種や社会背景が日本と異なるため、日本人で同様の結果が得られるかはわからない。また、1924~44年に誕生し1971年の時点で生存していた患者を対象にしており、現在の環境でもあてはまるかはわからない。
コメント
本研究は大規模かつ長期的な観察データを基に、胎児期の発育がその後のCKD発症と関連する可能性を示した点
参考文献
①低出生体重とCKD発症に関するSystematic Review(SR)。このSRではCKDをGFRと尿蛋白でキチンと定義している。②低出生体重とESKD発症に関する観察研究。200万人が対象で①に含まれる。低出生体重のESKD発症リスクは若年者(≦14歳)でより高い可能性を示唆。③低出生体重と糸球体数・糸球体サイズの関連に関する横断的研究。④糸球体数・糸球体サイズと腎臓病の関連に関する総説。③④はDOHaDの病態を考える上で参考となる。
①Is low birth weight an antecedent of CKD in later life? A systematic review of observational studies. Am J Kidney Dis. 2009;54:248.
②Low birth weight increases risk for end-stage renal disease. J Am Soc Nephrol. 2008;19:151.
③Glomerular number and size in autopsy kidneys: the relationship to birth weight. Kidney Int. 2003;63:2113.
④Glomerular number and size variability and risk for kidney disease. Curr Opin Nephrol Hypertens. 2011;20:7.
多発性嚢胞腎に対する腹膜透析は、有益なのか?
Outcome of autosomal dominant polycystic kidney disease patients on peritoneal dialysis: a national retrospective study based on two French registries.
Nephrol Dial Transplant. 2018;33:2020.
https://www.ncbi.nlm.nih.gov/pubmed/?term=29361078
1.背景
常染色体優性多発性嚢胞腎(ADPKD)は、腎容積が拡大し大腸憩室と腹壁ヘルニアの頻度も高いことから、多くの腎臓内科医はADPKD(PKD)の末期腎不全(ESKD)に対する腹膜透析に対して懸念がある。
2.論文の定式化(PICO/PECO)
① P:PKDのESKD患者
E:腹膜透析(PD)
C:血液透析(HD)
O:(主) 死亡 (副)腎移植
② P:PD患者
E:PKD
C:非PKD
O:(主)死亡 (副)PD離脱, 腹膜炎
3.研究デザイン & 統計解析
後向きコホート研究(観察研究)
生存時間分析(Fine & Grayモデル/競合リスクを考慮)
4.結果の吟味
①REIN registry(フランス)
PKDのPD患者638名とHD患者4653名の比較。
5年死亡:PD12%, HD14%, 調整HR1.19(0.87-1.63)
腎移植:PD60%, HD50%, 調整HR1.23(1.06-1.41)
②RDPLE registry(フランス)
PD患者でPKD797名と非PKD12059名の比較。
3年死亡:PKD10%, 非PKD31%, 調整HR0.56(0.45-0.69)
PD離脱:両群で差なし(Figure)
腹膜炎:PKD32%, 非PKD35%, 両群で差なし



研究結果は妥当なものか?(内的妥当性)
①群間の背景は同等か?
REIN registryでは、PDの方がHDよりも背景として予後がよさそうな患者が多く(女性, 若年, アルブミン高値, 非DM, 心血管病既往が少ない)、RDPLE registryでは、PKDの方が非PKDよりも背景として予後がよさそうな患者が多い(女性, 若年, 合併症が少ない)。また、両registryともに腎容積に関する情報がなく、腎容積の群間差についてわからない。
②PKDにおけるPD選択と予後の関連は妥当か?
患者背景が群間で異なることに対し、多変量解析にて調整しているが、治療選択に伴うバイアス(indication bias)の影響を免れない(予後がよさそうなPKD患者がPDを選択している可能性を否定できない)。また、臨床的に重要と考えられる腎容積が解析には考慮されていない。
③2つの観察研究の意義について
REIN registryとRDPLE registryはともにPKDに対するPDの研究として意義があるが、論点(PECO)が全く異なる。診療(治療選択)の観点からは、前者の方が有用なPECOと考えられる(診療上PD/HDは選択できるが、原疾患は選択できない/modifiable factorではない)。
自分の患者にあてはまるか?(外的妥当性)
本研究はフランス(およびフランス領)の腎不全患者が対象であり、人種や社会背景が日本と異なるために、日本人を対象に同様の結果が得られるかはわからない。医療背景についても、腎代替療法として腎移植を施行する割合が日本と比べて著しく高い。
コメント
本研究は、PKDのPD患者が、腎臓内科医が心配するほど予後不良ではない可能性を示しており、「PKDはPDの適応に乏しい」という偏見を払拭する点で意義があります。しかしこの結果から、患者背景によらず「PKD患者にPD, HDのどちらを選択しても予後は同等」とは言えず、「PKD患者にPDを選択した方が非PKD患者にPDを選択するよりも予後良好」と言うこともできません。治療選択には理由があり、PDに適した患者を選ぶのが腎臓内科医の役割である以上、そのバイアスを取り除くことは極めて困難です。本研究のようにRCTが困難なテーマでは観察研究が不可欠ですが、治療効果の検証に関しては特に慎重な吟味が必要となります。
参考文献
①PKDに対するPDについての総説。問題点の整理に役立つ。②PKDのPDに対するSystematic Review & Meta-analysis。なお、PKDと非PKDの比較であり、PKDのPDとHDの比較ではない。③PKDの腎容積・肝容積とPD関連アウトカムについての論文。PKDに対するPDの適応・限界について考える上で示唆に富む。
①Peritoneal Dialysis for Patients with Autosomal Dominant Polycystic Kidney Disease. Perit Dial Int. 2017;37:384.
②Outcome of polycystic kidney disease patients on peritoneal dialysis: Systematic review of literature and meta-analysis. PLoS One. 2018;13:e0196769.
③Peritoneal Dialysis is Limited by Kidney and Liver Volume in Autosomal Dominant Polycystic Kidney Disease. Ther Apher Dial. 2015;19:207.
CKD患者の高尿酸血症に対する治療は、腎予後を改善するか?
Febuxostat Therapy for Patients With Stage 3 CKD and Aymptomatic Hyperuricemia: A Randomized Trial (FETHER Study)
Am J Kidney Dis. 2018. [Epub ahead of print] PMID: 30177485
https://www.ncbi.nlm.nih.gov/pubmed/?term=30177485
1.背景
先行研究では高尿酸血症の改善がCKD進行を抑制することが示されているが、エビデンスは十分ではない。キサンチンオキシダーゼ阻害薬の早期CKDにおける有用性も不確かである。
2.論文の定式化(PICO/PECO)
P:CKDstage3で無症候性高尿酸血症※ の患者
I :フェブキソスタット(介入群)※※
C:プラセボ(比較群)
O:eGFRの経年変化 (ΔeGFR/年)
※組入基準 尿酸:7-10mg/dl
※※1日量:1-3週 10mg, 4-7週 20mg, 8-108週 40mg
3.研究デザイン & 統計解析
多施設共同二重盲検ランダム化プラセボ比較試験 (RCT)
Intention to treat (ITT) 解析
層別解析(性, 年齢, 尿酸値, 尿蛋白, BMI, DM, CKD stage, Cr値, 喫煙, 併存疾患)
4.結果の吟味
20歳以上の日本人467人が対象, 平均 65歳, 男77%, BMI24, DM30%, CKD Stage3a 50%, 尿酸値 7.8mg/dl。介入群でSBPが有意に高く、ACE-I/ARB内服が多い。
観察期間108ヵ月。ΔeGFR(ml/min/1.73m2/year)は2群間で有意差なし。
介入群0.23±5.26 vs 比較群−0.47±4.48, p=0.1
層別解析では蛋白尿陰性, 血清Cr低値で有意差あり(交互作用あり)。
有害事象は群間で有意差なし。





研究結果は妥当なものか?(内的妥当性)
①介入群と比較群で背景は同等か?
介入群でSBPがやや高くACE-I/ARBの内服もやや多いが、RCTとして動的割付が行われており、両群のバランスは概ね保たれている。
②介入と予後の関連は妥当か?
RCTでランダム割付が行われておりベースラインの群間差は吸収しうる範囲内である。またITT解析であるが割付後の脱落も少なく、交絡要因の影響は少ない。
サンプル数の設定に際して、先行研究に基づき両群のΔeGFRの差を2.7ml/min/1.73m2/year として計算しているが(プロトコール論文(参考文献①)を参照)実際の差は小さかった。その点は臨床的かつ統計学的に吟味が必要である。
自分の患者にあてはまるか?(外的妥当性)
日本人が対象で我々の患者にはあてはめやすい(ただし異なる人種で同様の結果が得られるかわからない)。また、尿酸値が7~10mg/dlのCKDstage3患者に限定されており、より尿酸高値の患者や、stage1,2または4,5のCKD患者への効果は言及できない。HbA1c≧8.4のDM, SBP≧160, DBP≧100, 重症合併症, 腎移植なども研究対象から除外されている。
コメント
無症候性高尿酸血症のCKD stage3患者を対象にした興味深いRCTですが、FebuxostatのCKD進行抑制効果についてプラセボとの有意差を検出できませんでした。Febuxostatの効果は予想よりも小さかったようです。一方、尿蛋白や血清Cr値が交互作用を有しており、病態と薬理作用の推察と併せ、患者に応じた治療差別化(テーラーメイド化)についての示唆を含みます。過去の観察研究の結果も併せて考えると、CKDに対する高尿酸血症の介入は、より早期の段階でないと効果が期待できないのかもしれません。
参考文献
①本研究のプロトコール論文。②米国の観察研究(CRIC)。高尿酸血症はGFR高値群では腎障害リスクであるが、GFR低値群では腎保護的に働く可能性あり。過去ログ参照。
https://nephrologist.hatenablog.com/entry/2018/09/12/073446
③2017年のメタアナリシス。尿酸低下療法の可能性について示唆。進行中の3研究に言及しており本研究(FETHER Study)がその1つ。④英国の観察研究。痛風患者へのアロプリノール投与がCKD発症を抑制する可能性について示唆。
②Uric Acid and the Risks of Kidney Failure and Death in Individuals With CKD. Am J Kidney Dis. 2018;71:362.
③Uric acid lowering therapies for preventing or delaying the progression of chronic kidney disease. Cochrane Database Syst Rev. 2017;10:CD009460.
④Association of Chronic Kidney Disease With Allopurinol Use in Gout Treatment. JAMA Intern Med. 2018;178:1526-1533.
進行したCKDへの腎専門医診療は、患者予後と関連するか?
Receipt of Nephrology Care and Clinical Outcomes Among Veterans With Advanced CKD.
Am J Kidney Dis. 2017; 70: 705-14.
https://www.ncbi.nlm.nih.gov/pubmed/?term=28811048
1.背景
K/DOQI, KDIGOガイドラインではeGFR<30で腎専門医への紹介が推奨されており、腎専門医への早期紹介が透析導入後の死亡リスク低減に寄与するという報告は複数ある。一方で、腎専門医診療によるESRDへの進展抑制に関して検証した報告は、DM患者や単一施設患者を対象とした研究に限られ、広く検証されていない。
2.論文の定式化(PICO/PECO)
P:進行期CKD(eGFR≦30)の外来患者
E:腎専門診療を受けている(専門医群)
C:腎専門診療を受けていない(非専門医群)
O:主要項目 ①死亡 ②ESRD
副次項目 腎関連パラメーター
3.研究デザイン & 統計解析
過去起点コホート研究(Landmark解析)
生存時間分析(Coxモデル, Fine-Grayモデル)
傾向スコア(PS)マッチングによる追加解析
4.結果の吟味
米国退役軍人39669人が対象。平均年齢76歳, 白人74%, DM56%, うっ血性心不全30%, 担癌20%, うつ21%, eGFR25。62%が腎専門医の診療を受けておらず、非専門医群ではHb, K, Ca, P, Albのコントロールが有意に不良。
平均観察期間2.9年で死亡37%、ESRD11%。専門医群の方が、死亡リスクは低いが(HR 0.88[95%CI 0.85-0.91])、ESRDへの進展リスクは高い(HR 1.48[1.38-1.58])。PSマッチでの解析結果も概ね同様。


研究結果は妥当なものか?(内的妥当性)
①腎専門医による診療の内容は?
本研究では腎専門医による具体的な診療内容はわからない。しかし専門医群では腎疾患関連のパラメーターは(それ程大きくはないが)有意に改善している。
②専門医群と非専門医群で背景は同等か?
非専門医群では、高齢者やVA copay, 心不全, 認知症, うつ, 腎機能低下の傾向が強い。
③腎専門医診療と予後の関連は妥当か?
年齢, 性別, 人種, 社会背景, 併存症を調整変数として多変量解析が行われているが、尿蛋白など調整が不十分な可能性は残る(residual confounding)。
PSマッチングを用いた解析も行っているが、腎専門診療の適応に関わる背景要因(indication bias)は完全に排除できない(専門医群でESKDリスクが高いのは、もともとESKDに移行しやすい患者を診ているからかもしれない)。
Landmark解析によってsurvival bias(immortal time bias)の影響は軽減されている。
観察研究であり、介入として腎専門医診療が生命予後を改善するかわからない(介入として腎専門医診療は透析導入を増やす(?)かは不明)。
自分の患者にあてはまるか?(外的妥当性)
米国退役軍人が対象で人種, 基礎疾患, 社会背景が日本人と大きく異なることから、日本人に対して同じ結果が得られるかわからない。またstage G4以上のCKD患者を対象としており、早期のCKD患者の予後については言及できない。
コメント
進行したCKD患者に対する腎専門医の診療が、良好な生命予後と関連する可能性が示された一方で、逆にESKD発症とも関連する結果となっています。
参考文献
①CKD患者に対する腎専門医への早期紹介とESKD抑制との関連を検証したメタ解析。観察研究のみでRCTなし。予後改善の可能性を示唆。②早期CKD患者に対する腎専門医診療と腎, 心血管, 生命予後の関連を検証した米国の観察研究(CRIC)。予後と有意な関連なし。③CKD患者に対する腎臓病療養指導を介入とした日本のRCT(FROM-J)。GRF低下の抑制効果はstage G3のみで有意(stage全体では有意差なし)。
①Early referral to specialist nephrology services for preventing the progression to end-stage kidney disease. Cochrane Database Syst Rev. 2014;(6):CD007333.
②Influence of Nephrologist Care on Management and Outcomes in Adults with Chronic Kidney Disease. J Gen Intern Med. 2016;31:22.
③Effect of Behavior Modification on Outcome in Early- to Moderate-Stage Chronic Kidney Disease: A Cluster-Randomized Trial. PLoS One. 2016;11:e0151422.